
 |
||
|
Valeria Rosso |
||
|
Universita' di Pisa e INFN Sezione di Pisa |
||
|
Lo sviluppo di tecniche sempre più accurate nell’identificazione di tumori è uno dei settori di ricerca medica con aspetti interdisciplinari dove si concentrano enormi sforzi ed investimenti, a fronte di grandi aspettative da parte della popolazione in tutto il mondo. Tra queste, la diagnosi precoce dei tumori alla mammella è uno degli obiettivi di maggior impatto sociale 1 . La mammografia a raggiX è, ad oggi, il metodo più affidabile per la rivelazione di lesioni mammarie ed è stato provato che lo screening mammografico è un’arma efficace nella riduzione della mortalità per tumore al seno 2 . Migliorare le tecniche mammografiche, e rendere possibile lo screening di settori sempre più larghi della popolazione, richiede sforzi ed innovazioni importanti ma di sicuro impatto. Non è dunque una sorpresa che da anni molti ricercatori siano impegnati nell’utilizzo in questo settore medico di tecniche di indagine sviluppate nell’ambito della ricerca sperimentale della fisica nucleare e subnucleare. All’interno delle ricerche interdisciplinari promosse e sostenute dall’INFN, operano diversi gruppi di ricerca che perfezionano tecniche di punta, ideate per un uso limitato alla ricerca di laboratorio, affinché esse raggiungano gli standard di affidabilità ed accuratezza necessari ad un loro utilizzo in ambito clinico. I risultati ottenuti hanno spinto nel marzo 1996 un gruppo di ricercatori a sottoporre al Ministero dell’Università e della Ricerca Scientifica e Tecnologica un progetto triennale intitolato “Imaging Mammografico Integrato” nell’ambito della Legge 46/82 (art.10)3 . Nel giugno del 2000 parte di questo progetto è stato finanziato su base triennale, ed è partito un programma che punta ad un utilizzo integrato di quanto di meglio la ricerca di base abbia prodotto negli ultimi anni. Questa collaborazione tra ricerca ed industria punta al raffinamento di tecniche e di apparati. L’obiettivo ultimo è di fornire prototipi di nuovi sistemi per l’imaging morfologico e funzionale ai fini dello screening, della diagnosi e del controllo del decorso della patologia tumorale del seno. Perché il progetto di Imaging Mammografico Integrato? La difficoltà di diagnosticare precocemente piccole patologie nelle mammografie è dovuta al fatto che l’attenua zione dei raggiX da parte del tessuto patologico è molto simile a quella del tessuto fibroso sano. Le differenze del coefficiente lineare di attenuazione 4 tra i vari tessuti sono dell’ordine del percento, e variano con l’energia del fotone incidente. Un tipico fascio usato in mammografia ha fotoni distribuiti nell’intervallo di energia da 10 a 30 keV. In Fig. 1 sono riportati gli andamenti dei coefficienti di attenuazione lineari dei principali tessuti di interesse che costituiscono un organo mammario (tessuto adiposo, tessuto fibroghiandolare, carcinoma). Il punto di partenza del progetto è la constatazione che, per migliorare la rivelazione di piccole patologie, sono necessari cambiamenti della strumentazione attualmente usata nell’esame mammografico. Occorre quindi intervenire sul generatore di raggiX, sul rivelatore ed infine, possibilmente, anche sul trattamento dell’informazione ottenuta. Migliorie del fascio Per quanto riguarda le migliorie da apportare al generatore del fascio di raggiX è necessario fare una considerazione preliminare. Al fine di esaltare i piccoli contrasti generati dai tessuti patologici mammari rispetto ai tessuti sani, si possono sfruttare le differenze in assorbimento dei fotoni da parte dei vari tessuti. Per ottenere questo risultato è conveniente utilizzare fotoni in un intervallo energetico molto più ristretto di quello normalmente impiegato. Quindi il primo obiettivo è la realizzazione di fasci di raggi X con una più ristretta distribuzione in energia (vengono detti fasci a banda stretta) rispetto al fascio utilizzato in un mammografo standard. Questo risultato è ottenuto sfruttando il fenomeno fisico della diffrazione di Bragg. Facendo incidere un fascio di fotoni con una data distribuzione in energia su un cristallo (monocromatore) è possibile selezionare in uscita fotoni di una energia specifica. Cambiando l’angolo di incidenza del fascio stesso è possibile modificare l’energia del fascio in uscita. L’efficienza di produzione del fascio di raggiX a banda stretta è bassa, pur utilizzando cristalli a mosaico di grafite pirolitica altamente orientata, e per ottenere un flusso di fotoni comparabile a quello che si usa normalmente in mammografia è necessario avere nuovi tubi a raggiX (ad alta capacità termica). Le distribuzioni in energia dei fotoni prodotti da un tubo mammografico standard e da un monocromatore sono riportate in Fig. 2. Migliorie nella rivelazione e nell’analisi La rivelazione dei fotoni avverrà utilizzando un dispositivo digitale invece del convenzionale sistema analogico costituito da una lastra radiografica accoppiata a uno schermo di rinforzo. Il sistema convenzionale ha infatti dei limiti notevoli sia per quanto riguarda il massimo intervallo di conteggi acquisibili (range dinamico) sia per quanto riguarda la linearità nella risposta al variare del numero di fotoni. Il sistema digitale proposto per l’imaging morfologico adatto per evidenziare le strutture dell’organo mammario, si basa su una matrice di rivelatori montati su due linee sfalsate in modo da effettuare una scansione dell’organo in esame per coprire un’area totale di 18x24 cm 2 . A questa matrice verrà accoppiato uno schermo in piombo, con aperture opportunamente sagomate. Lo schermo, posto tra la sorgente e la paziente, e la matrice di rivelatori si muoveranno in sincronia in modo da illuminare con i raggiX solo le zone che vengono via via acquisite (vedi Fig. 3). Un’area illuminata dai raggiX più limitata comporta un’elevata riduzione della quantità di fotoni che vengono deviati dalla loro direzione originale dall’organo radiografato e questo contribuisce a migliorare la rivelazione di particolari grazie alle piccole differenze del coefficiente lineare di attenuazione del tessuto patologico rispetto al tessuto sano. Il sistema digitale è un insieme di sensori, ciascuno di area 1,2 cm 2 , costituiti da diodi. Ognuno è fabbricato a partire da un cristallo di arseniuro di gallio (GaAs) spesso 200 micron, che ha un’efficienza di rivelazione per fotoni nell’intervallo 1030 keV circa doppia rispetto a quella di un rivelatore in uso in un sistema mammografico standard. Ciascun sensore è una matrice di 64x64 diodi quadrati di lato 170 micron più la relativa elettronica, in grado di rivelare il segnale di un singolo fotone. I vantaggi che derivano dal sistema appena descritto sono: • un’elevata risoluzione spaziale ( < 5 coppie di linee/ mm); • un elevato range dinamico (10 4 10 5 ); • una riduzione della dose ricevuta dalla paziente (< 50%); • una migliore capacità nella rivelazione di piccole patologie. Inoltre le immagini sono digitali per costruzione e quindi possono essere rielaborate con tecniche standard senza passare attraverso la digitalizzazione della lastra fotografica, come avviene adesso nei sistemi mammografici convenzionali. La produzione dei rivelatori in GaAs a pixel e il loro collegamento elettrico ai chip di lettura (bumpbonding), essendo un processo industriale innovativo, avverrà all’interno del progetto di Imaging Mammografico Integrato. L’uso del sistema digitale di rivelazione a scansione, di cui verrà realizzato un prototipo che differisce dalla versione non prototipale solo per il numero ridotto di rivelatori, porterà sicuramente a una più precoce rivelazione delle patologie mammarie. Ciò nonostante l’imaging morfologico ha, in generale, una limitata capacità di distinguere le lesioni benigne dalle maligne (specificità). Ciò spesso vuol dire che per arrivare alla diagnosi finale, si deve ricorrere a indagini invasive quali la biopsia. Metodi diagnostici non invasivi sono forniti dalla medicina nucleare. Uno di questi è la mammoscintigrafia che può evidenziare diversi gradi di attività funzionali (Fig. 4). In questo caso si inietta alla paziente una sostanza tracciante (radiofarmaco) emettitore di raggi gamma (fotoni). La sostanza viene scelta in modo che si addensi nella zona di interesse, che è più vascolarizzata. Rivelando i fotoni, si ricostruisce l’immagine della biodistribuzione del radiofarmaco. La tecnica è anche nota come Single Photon Emission Mammography o SPEM. L’idea di base è semplice ma la sua realizzazione, e soprattutto la possibilità di utilizzarla in ambito clinico, necessita un utilizzo combinato di tecniche estremamente sofisticate e varie. Nel nostro progetto il cuore della SPEM è costituito da una gamma camera 5 che utilizza come sistema di rivelazione una matrice di cristalli scintillanti di ioduro di sodio drogati con tallio (sensibili ai fotoni) accoppiati a tubi fotomoltiplicatori particolarmente compatti che permettono di ottenere un’elevata risoluzione spaziale (meglio di 1 mm). Le dimensioni ridotte dei tubi fotomoltiplicatori (Fig. 4d) consentono di costruire una gamma camera di spessore inferiore a 5 cm e con un’area tale da ottenere una visione completa dell’organo mammario. Un vantaggio molto importante è che la SPEM può essere eseguita in modo da riprodurre le stesse proiezioni geometriche della mammografia a raggiX. Perciò le immagini funzionali così ottenute sono sovrapponibili a quelle morfologiche, cosa che non può avvenire per i sistemi convenzionali di mammoscintigrafia che usano rivelatori di elevate dimensioni. Oltre alle caratteristiche di imaging complessivamente migliorate, la riduzione di peso conseguente alla riduzione delle schermature di piombo necessarie (dai 180 kg di peso della testata tradizionale ai 10 kg del prototipo) apre la possibilità di eseguire indagini in ambienti clinici quali, ad esempio, le sale operatorie e i reparti di emergenza. L’utilizzo dei sistemi di rivelazione sviluppati nell’ambito del progetto di Imaging Mammografico Integrato è ben più vasto delle applicazioni da noi inizialmente previste. In particolare il sistema di rivelazione, che verrà adoperato per l’imaging morfologico, è stato utilizzato come sistema per betaautoradiografia digitale. L’autoradiografia è una particolare tecnica di imaging utilizzata nella ricerca biomedica, biochimica e biofisica. Sono applicazioni che spaziano dal riconoscimento di strutture biologiche, al sequenziamento del DNA fino ad arrivare alla ricostruzione dei percorsi metabolici seguiti dalle molecole. Al fine di ottenere immagini autoradiografiche, ai campioni di interesse vengono fatti assorbire composti radioattivi emettittori di radiazione beta (fosforo 32, carbonio14, zolfo35, trizio) o di raggi gamma (iodio135), radiazioni che sono successivamente rivelate. Il sistema costruito, denominato BETAview consente di ottenere immagini autoradiografiche con buona risoluzione spaziale, di eseguire analisi quantitative e, soprattutto, permette l’osservazione e la registrazione, in tempo reale, di processi metabolici evolutivi quali l’assorbimento di amminoacidi. In particolare, con tale sistema è stata analizzata, in vivo, la cinetica di assorbimento di un amminoacido marcato con carbonio14 da parte di una struttura biologica (uova di polpo, octopus vulgaris) (Fig. 5). Conclusioni I sistemi proposti all’interno del progetto di Imaging Morfologico Integrato sono innovativi ed alla fine del triennio si punta a rendere disponibili: • un prototipo di un sistema mammografico digitale, completo di tubo mammografico standard e un prototipo mammoscintigrafico ad elevata risoluzione spaziale. Quest’ultimo prototipo sarà di dimensioni e affidabilità tali da renderne possibile l’uso in ambiente ospedaliero per la necessaria sperimentazione clinica; • il progetto di un nuovo strumento per la realizzazione di fasci X a banda stretta per mammografia e una versione dello strumento funzionante a bassa intensità; • un nuovo processo industriale innovativo per la realizzazione di rivelatori di GaAs a pixel e per il loro collegamento elettrico a chip di lettura; • il prototipo di un sistema di autoradiografia particolarmente mirato a studi del DNA. |
|||||||||
 |
|||||||||
|
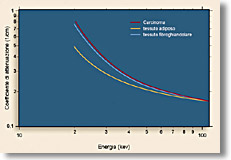
Fig. 1 Confronto tra i coefficienti di attenuazione lineare del carcinoma, del tessuto adiposo e del tessuto fibroghiandolare. La differenza tra i coefficienti lineari di attenuazione tra il tessuto fibroghiandolare e il carcinoma e’ compresa tra il 4% a 15 keV e l’1% a 25 keV |
|||||||||
 |
|||||||||
|
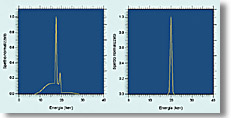
Fig. 2 Distribuzione in energia dei fotoni prodotti da un tubo mammografico standard e quello prodotto da un tubo a raggi X a banda stretta |
|||||||||
 |
|||||||||
|
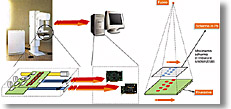
Fig. 3 Fotografia di un mammografo standard in cui verrà inserito il nuovo rivelatore digitale accoppiato allo schermo in piombo. L’acquisizione dei dati avverrà attraverso un PC |
|||||||||
 |
|||||||||
|
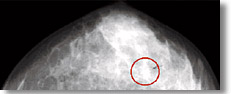
Fig. 4 A titolo di esempio viene mostrato un caso clinico dove l’esame mammografico RX (a) mostra una lesione di circa 7 mm (cerchio rosso). La scintimammografia tradizionale mediante Anger camera (b) non evidenzia aree di iperattività verosimilmente corrispondenti alla lesione presente nella mammografia. L’esame scintimammografico in SPEM (c), effettuato in proiezione cranio caudale, evidenzia chiaramente la lesione e la sua localizzazione spaziale (cerchio rosso). Una matrice di Position Sensitive Photo Multiplier Tube (d) (Hamamatsu R5900 C12) |
|||||||||
 |
|||||||||
|
Fig. 5 Evoluzione temporale dell’incorporazione di un amminoacido marcato con carbonio14 da parte di uova di octopus vulgaris. Ogni radiogramma visualizza lo stato del sistema biologico ogni 20 minuti; nell’ultimo radiogramma le cellule uovo sono cerchiate in rosso |
|||||||||
 |
||